你经常久坐不动么?你经常躺卧不锻炼么?亦或者你经常出差需要长时间乘坐交通工具么?
如果你属于以上之一,那么接下来你就需要注意了!
血管血栓是一种常见的血管病变,可以发生在任何年龄、任何时间,以上几点都容易引起血管血栓。
血栓一旦形成就会导致血管闭塞。更为可怕的是,血栓不仅可能发生在身体任何部位,严重的血管血栓闭塞会造成组织损伤甚至器官衰竭。除此之外,与血管栓塞伴随而来的还有心肌梗死、缺血性中风、静脉血栓栓塞等危及生命的心血管疾病。
由于血管血栓闭塞的诊断大多局限于晚期,因此治疗窗口很窄。在临床上,对于已有血栓形成的患者,治疗方式只有两种,及时尽快溶栓或手术。
其中,全身给予溶栓药物是最广泛使用的血栓治疗方法,但溶栓药物存在半衰期短、失活、生物利用度低、脱靶副作用(过敏反应和不必要的组织出血)以及血栓渗透受限等问题。
而手术治疗则需要患者的病情、身体条件来决定,并不适合所有患者。同时,手术取栓或置入支架不仅创伤大、花费高、术后治疗的效果也比较有限,复发的概率较高。
▍全球首创?登上顶刊?这个集磁性纳米机器人有点 !
!
当然,随着人口老龄化的持续如何高效率、低损害治疗血栓已成为医学界的焦点,也受到全社会广泛关注,越来越多研究人员开始投入精力至此领域,探索能够强效、低风险治疗血栓的方式方法。
凭借尺寸小、精度高、可定制化的优势,微纳米机器人一直以来都是血栓治疗方案的研究首选。只是已有微纳米机器人多为催化推进和光驱动,存在推力缓慢、只能在高离子强度生物环境中以单机器人水平进行运动,在血栓处积聚的时间长且溶栓治疗效果低的缺陷。
另一方面,迄今为止开发的可负载溶栓药物(包括t-PA、尿激酶纤溶酶原激活剂、肝素和链激酶)的集群磁性微纳米机器人在高离子强度血液环境中可能会出现严重的团聚和随机生物粘附。因此,在进行体内溶栓时,存在脱靶毒性、毛细血管堵塞和外源性刺激血栓形成等巨大风险,距离临床应用还很远。
针对这一临床难题,武汉理工大学材料复合新技术国家重点实验室和材料科学与工程国际化示范学院(微电子学院)官建国教授和牟方志(FangzhiMou)研究员团队以微纳米机器人为载体,对新的溶栓方法进行探索,开发了一种用于集磁性纳米机器人的HPB生物界面策略,并研制出可注射溶栓纳米机器人,实现了在不手术的前提下在病人体内进行安全有效溶栓。
在这项研究中,武汉理工团队通过开发超顺磁性纳米颗粒精心嫁接的类肝素-PSS刷作为构建块,构建了生物相容性的集群磁性纳米机器人。该纳米机器人可以在没有磁场的情况下可逆地转化为单独分散的纳米颗粒,并在血流中集体移动而不粘附到血管壁应用。通过机械破坏和靶向药物输送的协同作用,它们可以在体内进行安全有效的靶向溶栓。

该研究成果以“Swarming magnetic nanorobots bio-interfaced by heparinoid-polymer brushes for in vivo safe synergistic thrombolysis”为题刊登在国际顶级期刊Science子刊《Science Advances》上,并且被《Science Advances》期刊网站首页以“Injectable nanobots deliver drugs for targeted therapies”作为Featured image加以推介。
如此厉害的微纳米机器人到底长啥样?接下来便一起来看看这个纳米机器人是如何设计实现的吧!
▍专用于集群磁性纳米机器人,推出 HPB 生物界面策略
对于微纳米机器人的体内生物学应用,尤其是在血液系统重工作的可注射微纳米机器人,保证安全性是首要任务,但此前已开发微纳米机器人极少可以实现。
在血管中工作的纳米机器人需与血液环境兼容,具备高血液分散性、良好的抗凝性和可忽略的溶血。研究人员发现,类肝素物质含有大量的功能性基团,可以获得密集的表面电荷并与抗凝血酶III (AT III) 结合。它们在血液中表现出出色的抗凝作用并阻止血液凝固级联反应。以此为灵感,研究团队开发了一种用于集群磁性纳米机器人的 HPB 生物界面策略。
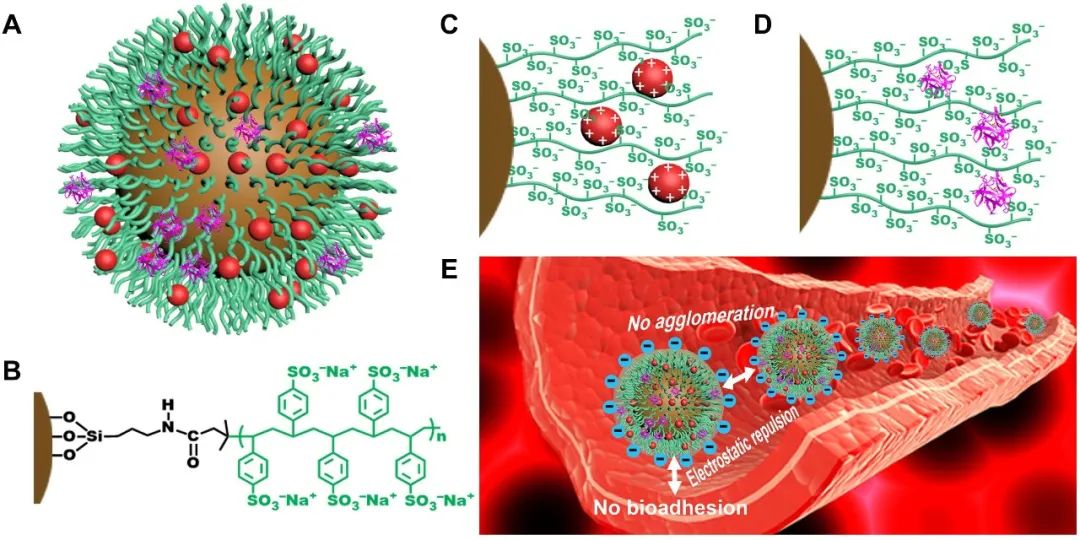
通过将表面引发的ATRP制造的MB@PSS NP(图A和B)设计为集群磁性纳米机器人的构建块——集群HPB-NR。同时,通过表面类肝素-PSS刷,MB@PSS NPs可获得密集的表面电荷,这使得它们能够在高离子强度血液环境中作为单独的构建块良好地分散,而无需B(t),因为强烈的局部静电排斥和进一步为它们提供丰富的结合位点,通过吸引的静电相互作用加载溶栓药物(图C)。此外,由于与 AT III 具有优异的亲和力(图D),它们还可能表现出高自抗凝作用,同时由于与 AT III 的强静电排斥它们也表现出低溶血和强抗生物粘附性(图 E)。
在外部磁场下,由于MB@PSS NPs之间磁引力和静电斥力的平衡,它们可以可逆地组装成棒状纳米结构。这些可逆组装的棒状纳米结构在施加替代磁场B ( t ) 时可以作为集群 HPB-NR。由于高磁化强度和局部流体动力相互作用,它们可以表现出强大的驱动力并被集体导航到目标位置。
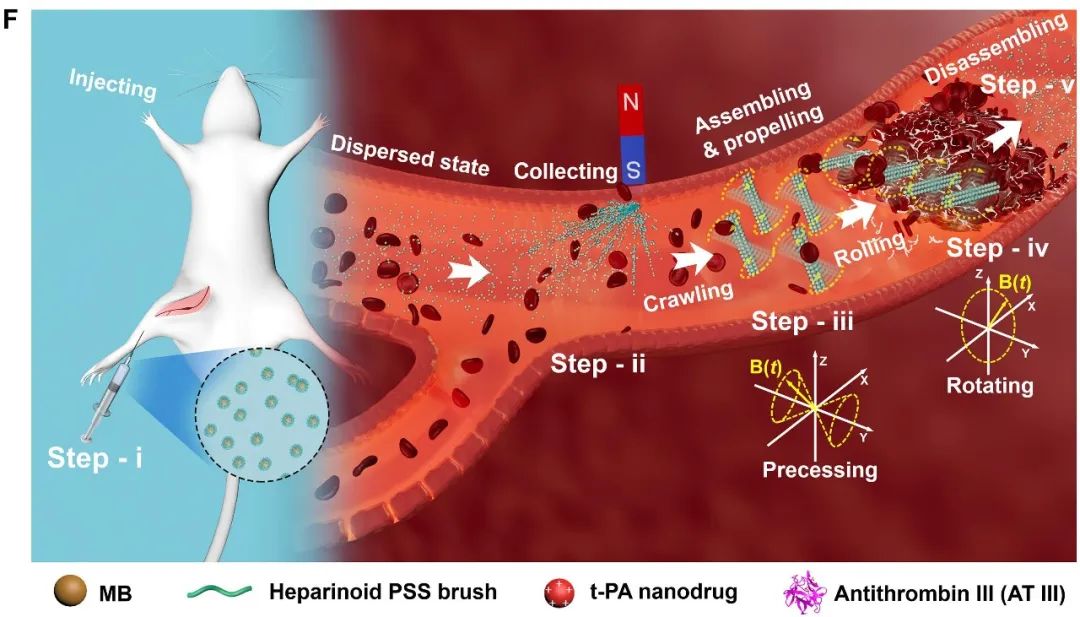
凭借这些综合优势,当MB@PSS NPs被注射到血栓部位远端的血流中,它们可以以分散良好的单个颗粒的形式通过血流被动运输(图F),随后使用放置在血栓部位上游的永磁体进行收集,由于血栓的血流阻塞,血流速度接近于零(图F,步骤ii)。移除磁铁并应用进动B ( t ) 后,负载组织型纤溶酶原激活剂 (t-PA) 的 HPB-NR 由负载 t-PA 的 MB@PSS NP 组装而成,并开始向血管壁附近的血栓,血流干扰最小(图F,步骤 iii)。
在此过程中,HPB-NR 的所有组成部分由于它们之间存在强大的静电排斥力,因此不会粘附在血管壁上。当接近血栓时,负载t-PA的HPB-NRs进一步受到旋转B(t)的驱动,进行旋转运动并穿透血栓,利用血栓中的机械破坏和局部药物释放来协同溶栓(图F,步骤-iv),这使得血凝块可以迅速再通。去除B ( t )后血流中的HPB-NRs会自动分解成分散的单个NPs,使其安全地参与循环,并通过身体的新陈代谢(图F,步骤-v)最终被清除出体外。因此,团队所构建的集群磁性 HPB-NR 预计具有生物相容性,并且可以解决迄今为止开发的运动靶向溶栓 MNR 中出现的关键生物安全问题。
▍体内外溶栓双测试,确认有效性
为了研究 HPB-NRs 体内的靶向溶栓作用,研究团队建立了 Sprague-Dawley (SD) 大鼠股静脉静脉血栓模型和溶栓治疗的实验装置(如图A所示)。通过使用FeCl 3损伤法制备股静脉静脉血栓,血栓产生时模型血管中的血流被阻断(图B),形成阻微纳米机器人或溶栓药物到达血栓部位的条件。
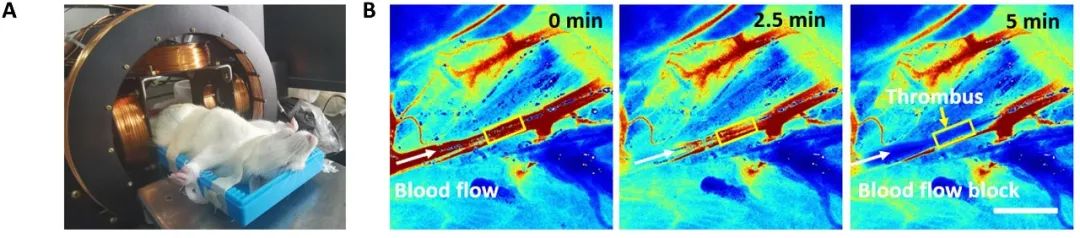
股静脉血栓模型建立后,研究人员在股静脉血栓远端注射磁性MB@PSS NPs,并通过磁性收集观察到声强度显着增强(如图C所示),这表明MB@PSS NP 在血栓部位附近积累。
通过图D可以看到,随着治疗时间的逐渐加长,除对照组(生理盐水)组外,所有治疗组均具有溶栓作用,但溶栓趋势不同。NRs+ B ( t )组在4小时治疗后仅显示血流信号轻微增加,t-PA组也是如此。前者表明单独的机械力太弱,不足以对血栓造成严重损伤,而后者则由于缺乏靶向能力而表现出药物利用率较低。相比之下,NRs+t-PA组由于t-PA的靶向递送,在治疗4小时后有明显的血流信号。更吸引人的是,与其他三组相比,NRs + t-PA + B ( t ) 组明显表现出快速溶栓。
血流量的定量分析(图E)则表明,除对照组外,所有治疗组的血流量均随时间逐渐增加。其中,NRs+t-PA+ B ( t )组的血流量增量最大,高于NRs+ B ( t )组和NRs+t-PA组的血流量之和,证实了HPB-NR 的体内溶栓也证明了靶向t-PA 递送和机械破坏的协同效应,与体外溶栓实验一致。通过测量不同治疗后的残余血栓面积,也可以观察到NRs+t-PA+ B ( t )组的协同溶栓性能(图F)。上述体内溶栓结果清楚地证实了负载t-PA的HPB-NRs能够有效溶解股静脉中的血栓。由于聚集的HPB-NRs可以可逆地转换成血清中不含B ( t )的分散良好的个体NPs ,因此这种运动靶向平台可能不存在HPB-NRs本身继发血栓形成的风险。
关于体外溶栓,研究团队也设计了微流控芯片来可视化 HPB-NR 的溶栓情况。在磁驱动和导航下,一群负载 t-PA 的 HPB-NR 通过微通道,并通过爬行运动(图A 中的 0 至 12.1 秒)向放置在微孔中的血栓移动,然后利用其滚动运动穿透血栓(图A)。
在光学显微镜下可以清楚地观察到负载t-PA的纳米机器人随后的溶栓过程(图B)。溶栓过程中,HPB-NRs在旋转B ( t )作用下,在血栓附近或血栓内局部释放t-PA,治疗3.5小时后血栓基本溶解。

在目视观察HPB-NRs的溶栓效果后,研究团队进一步评估了其体外溶栓效果。除对照组外,其余四组均观察到上清液颜色变化和血栓尺寸减小,提示血栓溶解的发生(图C )。移动的HPB-NRs[NRs+ B ( t )]组中明显的血栓溶解表明纳米机器人的机械力可以起到溶栓作用。移动的 t-PA 负载 HPB-NRs [NRs + t-PA + B ( t )] 组中的上清液颜色比其他组中的颜色深得多(图D),这表明NRs+t-PA+ B ( t )组血凝块释放的纤维蛋白和血红蛋白浓度最高,进一步验证了蜂群t-PA的溶栓作用最强。
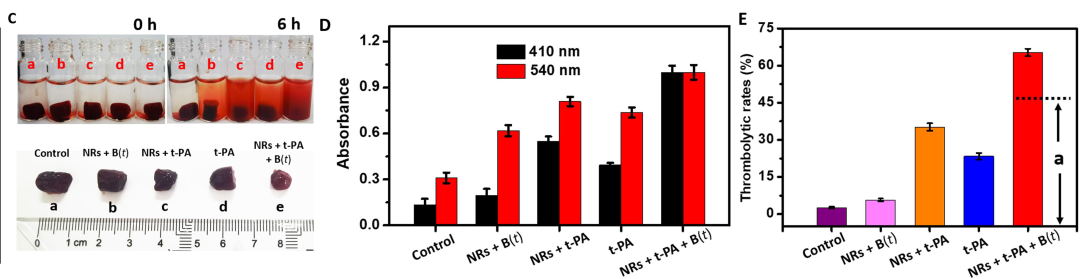
通过图E中可以看到,NRs + t-PA 组表现出比 t-PA 组更高的溶栓率 (ψ t ),这意味着t-PA对血栓成分的亲和力强于对PSS刷的亲和力,并且MB@PSS NP上负载的t-PA分子可以有效地扩散出PSS刷。此外,与游离t-PA相比,负载t-PA的平均扩散长度较短,因为前者可以在重力作用下直接与血栓接触。NRs + t-PA + B ( t ) 组的ψ t高于 NRs + B ( t ) 和 NRs + t-PA 组的总和,表明溶栓时机械破坏和靶向药物溶出具有协同作用移动的 t-PA 负载 HPB-NR。这种协同效应可以通过增强 t-PA 的扩散和释放与大量 t-PA 负载的 HPB-NR 的机械破坏相结合来合理化。
首先,从移动的负载t-PA的HPB-NR中释放的t-PA百分比(超过50%)可以通过磁性增强,超过从固定的负载t-PA的MB@PSS NP中观察到的百分比(15%)。这增加了 t-PA 的本地可用性。其次,滚动的HPB-NRs可以通过机械破坏在旋转的B ( t )下渗透到血栓中,并进一步促进t-PA在血栓内的局部输送。这改善了 t-PA 的转移和利用。凭借这两种效应,装载 t-PA 的 HPB-NR 比装载 HPB-NR 和固定装载 t-PA 的 MB@PSS NP 的组合更有效地进行溶栓。
体外和体内实验证实,集群HPB-NRs可以通过协同的“运动靶向”药物输送和机械破坏来安全有效地进行溶栓,并且大鼠模型中的股静脉血栓可以在4小时内完全溶解由负载 t-PA 的 HPB-NR 进行。由于其优异的血液相容性和较高的溶栓功效,预计大量 HPB-NR 还可以安全地治疗更具挑战性的血栓性疾病。
▍关于安全与未来
对于在血液循环系统中工作的可注射微纳米机器人,其安全性评价至关重要。研究团队通过实验进行了整体安全性评估。该评估包括全面的血液生化小组、组织学分析以及以裸 MB 作为对照的 HPB-NR (MB@PSS NP) 构建模块的生物分布。
观察期间,将 HPB-NR (MB@PSS NP) 的构建模块注射到小鼠血管中2天和14天后,小鼠情绪稳定,没有观察到任何小鼠的炎症反应或坏死。
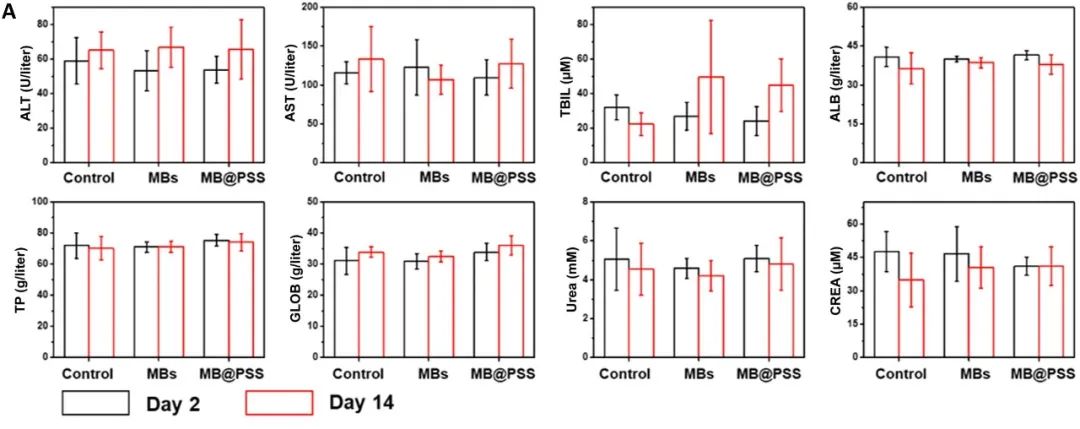
血液生化分析(图A)显示,与对照组相比,给予裸MB(没有PSS刷)的小鼠在14天后表现出TBIL升高,表明肝损伤。注射裸MB和 MB@PSS NP 的小鼠的心脏、肝脏、脾脏、肺和肾的苏木精和伊红 (H&E) 染色切片短期(2天)和长期(14天)均未出现明显的病理变化或炎症病变。
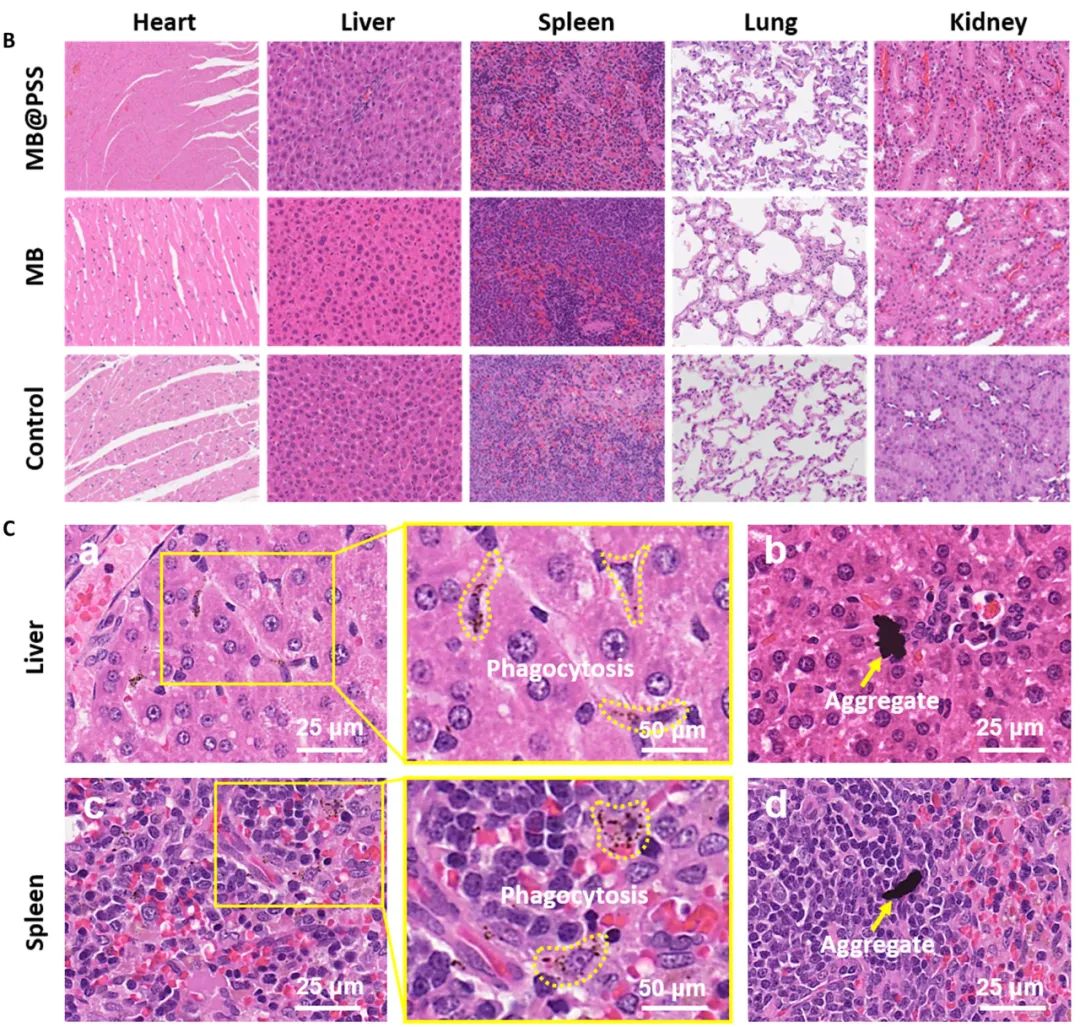
第 14 天时,研究团队详细研究了 MB@PSS NP 在小鼠体内的生物分布,发现MB@PSS NPs主要存在从血液中清除纳米颗粒的主要器官肝脏和脾脏中。这些器官中存在的所有MB@PSS NP都被免疫细胞吞噬,这表明它们最终会被排出体外。与之形成鲜明对比的是,肝脏和脾脏中存在的MB主要以聚集体形式存在,难以被免疫细胞吞噬,长期可能对这些器官造成损害。
这表明基于MB@PSS NPs的集群磁性纳米机器人拥有优异的生物安全性,具有溶栓临床应用的潜力。这项工作为生物医学纳米机器人提供了一种合理的多方面HPB生物界面设计策略,未来预计将有大量 HPB-NR作为通用运动平台来加载和递送不同的带正电荷或正电荷修饰的药物,靶向肿瘤治疗和感染控制等靶向治疗。。
当然,需要提醒大家的是,科技的进步能治愈疾病,却修复不了患病时期的痛苦煎熬,希望大家将健康放在首位,勤加锻炼,强健体魄!
参考链接:https://www.science.org/doi/10.1126/sciadv.adk7251
----------------END-------------------